Reproduksi pada karang memperlihatkan suatu variasi yang tinggi, baik antara spesies maupun dalam spesies di lokasi yang berbeda. Sebagai contoh karang Pocillopora verrucosa melakukan brooding (mengerami) di Atol Enewetak (Stimson, 1978), tetapi spawning (memijahkan gametnya) di Laut Merah (Shlesinger & Loya, 1985). Demikian pula pada jenis P. damicornis ditemukan memijahkan gametnya di bagian timur Pasifik (Glynn et al., 1991), tetapi mengerami di Enewetak dan Hawaii (Richmond & Jokiel, 1984; Stoddart & Black, 1985). Hal yang menarik bahwa P. damicornis ditemukan memijahkan gametnya dan juga mengerami planulanya di Pulau Rottnest, Australia Barat (Ward, 1992). Dari kedua cara reproduksi tersebut, tipe pemijah merupakan cara reproduksi yang dominan pada karang, yaitu 168 dari 210 spesies karang (Richmond & Hunter, 1990). Meskipun demikian cara reproduksi ini juga memperlihatkan variasi menurut lokasi, sebagai contoh cara reproduksi dengan mengerami lebih dominan di Karibia (Richmond & Hunter, 1990) tetapi di Great Barrier Reef (GBR) didominasi oleh jenis karang yang memijah (Babcock et al., 1986).
Karang tidak memiliki ciri seksual sekunder yang dapat digunakan untuk membedakan jenis kelaminnya. Oleh karena itu gonad yang hanya dapat dilihat melalui pembedahan merupakan cara satu-satunya dalam menentukan jenis kelamin suatu jenis karang (Harrison & Wallace, 1990). Jenis kelamin pada karang terdiri atas gonokorik dan hermafrodit (Richmond & Hunter 1990, Harrison & Wallace, 1990; Richmond, 1997). Dari 210 jenis yang telah diteliti, sebanyak 142 jenis tergolong hermafrodit simultan, yaitu suatu individu dapat menghasilkan gamet betina (telur) dan gamet jantan (sperma) dalam waktu yang bersamaan (Richmond & Hunter, 1990).
Proses gametogenesis pada karang secara umum bersiklus dan biasanya memperlihatkan ritme tahunan atau menurut fase bulan. Siklus gametogenesis pada karang memperlihatkan variasi menurut cara reproduksi karang, yaitu jenis yang memijahkan gametnya untuk pembuahan di luar tubuh, umumnya memiliki siklus gametogenesis yang tunggal dalam setahun, sedangkan jenis yang mengerami planulanya memiliki siklus gametogenesis yang berganda (multiple gametogenic cycles) (Harrison & Wallace, 1990). Demikian pula terlihat adanya variasi menurut lokasi (lintang), sebagai contoh karang Acropora (Isopora) palifera di Lae, Papua Nugini (daerah tropik) memiliki enam siklus gametogenesis, sedangkan di Pulau Heron (GBR) jenis ini memiliki hanya satu kali siklus gametogenesis (single gametogeneic cycles) dalam setahun (Kojis, 1986 a,b).
Dalam artikel ini akan diulas mengenai beberapa aspek reproduksi seksual karang Acropora nobilis dan Pocillopora verrucosa berdasarkan pendekatan histologi yang dilakukan di periairan terumbu karang tropik Pulau Barranglompo (PBL) Makassar, Sulawesi Selatan.
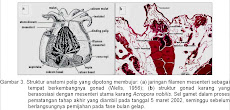
Gonad A. nobilis berasosiasi dengan 12 mesenteri, yaitu pada untaian filamen mesenteri. Gonad berkembang dalam sel benih (germ cells) yang mengelompok antara 2-8 sel (umumnya 5-8 sel). Sel benih ini berbentuk dambel dan merupakan perluasan dari filamen mesenteri dengan sebuah tangkai. Sel benih ini selanjutnya berkembang menjadi ovarium dan testis dengan proporsi yang relatif sama. Ovarium lebih dahulu berkembang dibandingkan dengan testis. Setelah musim reproduksi berakhir, sel benih menghilang dan filamen mesenteri terlihat kosong dengan mesoglea terlihat jelas dan melebar.
Ketika gonad dalam proses pematangan, gonad-gonad tersebut bergerak ke arah mulut polip. Ovarium dan testis mengalami proses pematangan secara bersamaan (seksualitasnya tergolong hermafrodit simultan) di bawah rongga mulut. Gonad-gonad matang ini memanjang dan teruntai menyerupai tabung dalam ruang gastrovaskular (rongga perut) di bawah mulut .
Gonad jantan (testis) yang matang berisi sejumlah besar massa sperma dengan bentuk lobus dan umumnya berbentuk buket, jumlah lobus dalam setiap testis berbavariasi dari 3 sampai 20 lobus. Sedangkan untuk gonad betina (telur) dalam satu lobus/ovarium juga bervariasi antara 1- 4 butir telur per lobus.
Setelah pemijahan baik pada bulan purnama ataupun bulan gelap selalu didapatkan adanya testis matang yang tidak dipijahkan, bahkan setelah berakhir musim pemijahan untuk siklus pertama (Desember-Februari) didapatkan testis matang yang mengalami atresia dari sampel histologi tanggal 27 Maret 2002 dan sebaliknya tidak ada sisa telur matang yang tidak dipijahkan ataupun telur matang yang mengalami atresia.
Karang A. nobilis atau karang-karang yang melepaskan gametnya dalam bentuk kemasan, semua telur matang akan dipijahkan, sedangkan sperma dibutuhkan hanya sebahagian dari sperma matang yang tersedia sehingga sering didapatkan sisa sperma matang atau sperma yang mengalami atresia setelah jenis karang ini memijah.
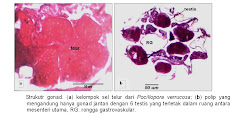
Gonad P. verrucosa juga berasosiasi dengan 12 mesenteri. Posisi gonad terletak di antara dua mesenteri atau terselip antara dua mesenteri (antara septa siklus pertama dan septa siklus kedua). Gonad berkembang dari sel benih (germ cells), tiap mesenteri hanya mengandung satu sel benih. Sel benih ini berbentuk dambel dan merupakan perluasan dari filamen mesenteri dengan sebuah tangkai dan selanjutnya berkembang menjadi sel gamet. Setelah musim pemijahan berakhir, sel benih kemudian menghilang dan ruang antara mesenteri terlihat kosong.
Gonad jenis P. verrucosa berbentuk bulat lonjong dan tetap berada di antara dua mesenteri sampai gonad tersebut matang dan siap dipijahkan. Terdapat tiga macam struktur gonad yang ditemukan dalam suatu polip, yaitu (i) polip yang di dalamnya hanya berkembang sel gonad betina (ovarium) dengan jumlah masing-masing satu untuk setiap mesenteri. Setiap ovarium memiliki jumlah sel telur yang bervariasi antara 1 sampai 11 butir; (ii) polip yang hanya mengandung sel gonad jantan (testis) dengan jumlah testis masing-masing satu untuk setiap ruang antara mesenteri utama (septa siklus pertama) dengan total jumlah 6 testis per polip dan (iii) polip yang mengandung kedua jenis gonad, baik ovarium maupun testis. Struktur gonad yang ketiga ini juga memiliki 2 variasi, yaitu polip dengan jumlah ovarium yang lebih dominan dan polip dengan jumlah testis yang dominan, tetapi secara umum variasi yang pertama lebih sering teramati. Sampel yang diambil secara mingguan (menurut fase bulan) teramati bahwa gonad-gonad tersebut mengalami pematangan secara simultan seminggu sebelum pemijahan (seksualitasnya tergolong hermafrodit simultan).
Sampel histologi yang diambil pada setiap fase bulan selama dua siklus bulan didapatkan 219 polip yang reproduktif dari 400 polip (80 koloni) yang diperiksa. Polip yang umum ditemukan, yaitu polip yang hanya mengandung ovarium dan yang mengandung ovarium dan testis dengan proporsi yang relatif sama, yaitu masing-masing sebesar 38, 63% (84 polip) dan 36,53% (80 polip), sedangkan polip yang hanya mengandung testis hanya sebesar 25,11% (55 polip) dan berbeda nyata (χ2:6,77; P<0,05).
a. Struktur dan Kondisi Gonad
Umumnya ovarium dan testis karang berkembang pada mesenteri, di dalam mesoglea atau gastrodermis (Harrison & Wallace, 1990). Jenis karang A. nobilis dan P. verrucosa memperlihatkan gonad yang berasosiasi dengan 12 mesenteri utama. Gonad yang berkembang pada ke-12 mesenteri utama juga ditemukan pada karang Poritidae di Pasifik bagian timur (Glynn et al., 1994). Gonad dihasilkan oleh sekelompok sel benih (germ cells) yang menyerupai dambel dan merupakan perluasan dari filamen mesenteri. Gonad dari kedua jenis karang ini mirip dengan yang ditemukan pada jenis Seriatopora caliendrum, Pocillopora damicronis, Stylopora pistillata dan genus Acropora, yang berkembang pada sebuah tangkai, melekat dan merupakan perluasan bidang mesenteri. Gonad ini diselimuti oleh mesoglea dan gastrodermis (Harrison & Wallace, 1990) dan oleh banyak penulis tangkai tempat berkembangnya gonad ini diistilahkan dengan sel benih.
Gonad kedua jenis karang yang diteliti juga teramati berkembang dalam lapisan mesoglea. Gonad-gonad tersebut kemudian bergerak menuju mulut (di bawah kerongkongan) ketika masuk tahap pematangan. Gonad pada karang A. nobilis memanjang dan menyerupai tabung dan tergantung di dalam rongga gastrovaskular di bawah mulut. Sedangkan gonad P. verrucosa terlihat berbentuk bulat. Perbedaan tersebut semata-mata karena penyesuaian terhadap bentuk polip itu sendiri. Polip dari A. nobilis memang terlihat lebih panjang (menyerupai tabung) dibandingkan dengan polip P. verrucosa yang cenderung bulat.
Sel telur dan testis dari A.nobilis selalu didapatkan dalam polip yang sama dengan struktur yang mirip dengan sembilan spesies simpatrik dari genus Acropora yang ditemukan oleh Wallace (1985) di Australia Timur. Sedangkan pada P. verrucosa, sel telur dan testis terdapat secara terpisah atau bersama-sama dalam polip yang sama dan memperlihatkan ukuran atau volume testis yang lebih besar dari volume telur. Hal yang sama juga teramati pada karang P. damicornis dan P. elegans di bagian timur Pasifik (Glynn et al., 1991).
Secara visual kedua jenis karang yang diteliti memiliki perbedaan yang mendasar dalam perbandingan volume antara gonad mereka. Secara kualitatif volume telur pada A. nobilis lebih besar dari volume testis dan sebaliknya volume testis lebih besar daripada volume telur pada P. verrucosa. Menurut Sakai et al. (2000), tingginya kejadian pembuahan sendiri (self-fertilization) dihasilkan oleh rasio testis:telur yang lebih rendah. Dengan demikian jenis A. nobilis berdasarkan rasio gonadnya cenderung melakukan pembuahan sendiri dan sebaliknya jenis P. verrucosa cenderung melakukan pembuahan silang (cross-fertilization).
b. Seksualitas, Cara dan Pola Reproduksi
Hasil pengamatan histologi memperlihatkan bahwa seksualitas A. nobilis dan P. verrucosa di PBL bersifat hermafrodit simultan, yaitu sel telur dan sperma berkembang dalam polip yang sama dan mencapai tahap kematangan dalam waktu yang bersamaan. Hasil ini juga diperkuat dari hasil pengamatan in situ ketika berlangsung pemijahan di alam, yaitu A. nobilis memijahkan gametnya dalam suatu paket telur-sperma yang matang dan P. verrucosa teramati polip yang hanya mengeluarkan sperma atau telur dan polip yang mengeluarkan telur-sperma secara terpisah dalam waktu yang bersamaan. Tipe seksualitas ini merupakan tipe umum pada karang skleraktinia (Harrison & Wallace 1990, Richmond & Hunter, 1990; Richmond, 1997). Kebanyakan spesies yang diidentifikasi sebagai hermafrodit simultan, umumnya dimiliki oleh famili Acroporidae, Faviidae dan beberapa Pocilloporidae (Richmond, 1997). Sedangkan untuk hermafrodit sekuensial teramati hanya pada sebagian kecil spesies karang, sebagai contoh yaitu Stylophora pistillata (Rinkevich & Loya, 1979) yang pada tahun-tahun pertama bereproduksi (koloni yang lebih kecil) sebagai jantan dan pada koloni yang lebih besar ditemukan lebih banyak gonad betina, demikian pula pada Goniastrea favulus (Kojis & Quinn, 1985).
Seksualitas dengan tipe hermafrodit merupakan salah satu bentuk adaptasi dari suatu populasi dengan kelimpahan yang rendah (Richmond, 1997). Tipe ini menguntungkan ketika peluang untuk bertemu lawan kelamin rendah dan memungkinkan terjadinya pembuahan sendiri. Hasil pengamatan pada Acropora tenuis dan A. humilis didapatkan 100% embrio berkembang dari hasil pembuahan sendiri, sedangkan dari pencampuran gamet menghasilkan planula yang gagal berkembang (Richmond & Hunter, 1990).
Pada semua sampel histologi juga terlihat adanya variasi struktur gonad dalam setiap polip P. verrucosa, yaitu polip yang hanya mengandung testis (polip jantan), polip yang hanya mengandung sel telur (polip betina) dan polip yang mengandung baik sel telur maupun testis (hermafrodit). Variasi polip dari hasil histologi ini juga ditemukan ketika dilakukan pengamatan in situ saat berlangsung pemijahan di alam. Meskipun terdapat tiga variasi polip menurut struktur gonadnya, namun polip yang mengandung ovarium (polip betina) dan polip yang mengandung ovarium dan testis (hermafrodit) terlihat lebih dominan dalam penelitian ini. Jadi dapat dinyatakan bahwa karang ini memiliki variasi tipe seksualitas yang tinggi. Kondisi yang sama juga teramati pada tipe seksualitas gonokorik seperti yang diamati pada jenis Agaracia agaricites, Acropora humilis dan Caryophyllia ambrosia yang diistilahkan dengan tipe “gonokorik labil” (Harrison& Wallace, 1990). Suatu spesies karang tidak hanya memperlihatkan keragaman dalam tipe seksualitasnya tetapi juga memperlihatkan adanya keragaman dalam cara reproduksinya, sebagai contoh karang Pocillopora damicornis ditemukan memijahkan gametnya dan juga mengerami planulanya di Pulau Rottnest, Australia Barat (Ward, 1992). Fenomena ini sekaligus membuktikan bahwa karang skleraktinia memiliki plastisitas reproduksi yang tinggi.
Dalam penelitian ini, potongan sampel polip hanya diamati dalam tiga seri pemotongan yang berurutan, maka tidak menutup kemungkinan adanya bias dalam pengamatan proporsi polip menurut struktur gonadnya, oleh karena itu diperlukan pengamatan secara terperinci dari suatu seri potongan histologi yang berurutan untuk sebuah polip secara utuh sehingga dapat dipastikan proporsi polip dari ketiga variasi struktur gonad tersebut.
Dari pengamatan histologi, seluruh sampel yang diperiksa tidak pernah ditemukan adanya larva planula selama masa reproduktif terutama saat masuk fase bulan purnama ataupun bulan gelap, tetapi hanya berisi sel telur dan testis. Fenomena ini menegaskan bahwa A.nobilis dan P. verrucosa tergolong karang yang menebarkan gametnya dalam kolom air (broadcast spawning) dengan fertilisasi berlangsung di luar tubuh atau polip (bertipe pemijah sejati). Hasil ini meyakinkan karena potongan cabang yang diambil contohnya langsung difiksasi di tempat (fiksasi secara langsung dapat menghindari suatu polip melepaskan gamet atau larvanya ketika dalam pengangkutan sampel ke darat). Karang yang bereproduksi dengan cara memijah (broadcast spawning) mewakili sebagian besar karang skleraktinia (Harrison & Wallace, 1990; Richmond & Hunter, 1990), sedangkan yang mengerami (brooding) mewakili hanya sebagian kecil karang (Richmond 1997). Sebagai contoh, karang kipas Pasifik Pocillopora damicornis melepaskan planula yang dierami (brooded) menurut suatu siklus bulan secara bulanan sepanjang tahun (Richmond & Jokiel, 1984; Nakir, 2003).
Cara reproduksi merupakan suatu bentuk adaptasi terhadap kondisi lingkungan atau menunjukkan sejarah gangguan dari suatu lokasi. Menurut Stimson (1978), karang yang mengerami ditemukan lebih dominan di rataan terumbu dangkal yang banyak mengalami gangguan, sedangkan karang-karang yang memijah lebih mendominasi pada perairan yang kurang mengalami gangguan. Perbedaan antara kedua cara reproduksi tersebut dipengaruhi oleh banyak aspek ekologi karang yang meliputi transfer alga simbiotik ke larva, kemampuan larva (selama periode tersebut larva memiliki kemampuan untuk dapat berhasil menempel dan bermetamorfosis), penyebaran larva, pola distribusi geografi, variabilitas genetik serta laju spesiasi dan evolusi (Richmond, 1990).
Berdasarkan tipe seksualitas dan cara reproduksinya maka kedua jenis karang yang diteliti memiliki pola atau strategi reproduksi dengan sifat pemijah yang hermafrodit simultan (Broadcast spawning simultaneous hermaphrodite), yaitu suatu strategi reproduksi dengan cara menghasilkan dua jenis gamet (telur dan sperma) yang matang secara bersamaan dan menebarkan gamet tersebut dalam kolom air untuk pembuahan dan perkembangan embrio.
Di daerah Indo-Pasifik, umumnya karang-karang memiliki pola pemijah baik yang hermafrodit ataupun gonokorik (Harriot, 1983). Pola ini menunjukkan bahwa karang-karang tersebut berada di bawah kondisi lingkungan yang menguntungkan dengan ukuran koloni yang lebih besar (diameter >30 cm) yang secara tidak langsung menunjukkan bahwa spesies tersebut berumur panjang, sedangkan spesies yang mengikuti pola pengeram baik yang hermafrodit ataupun gonokorik, secara umum berukuran kecil, yang secara tidak langsung menyatakan adanya penurunan pertumbuhan dengan peningkatan umur dan atau kematian induk yang tinggi (Szmant, 1986).
Hasil penelitian dengan pendekatan biologi reproduksi ini, dapat mencerminkan kondisi ekologi dalam ekosistem terumbu karang di PBL, yaitu tidak terjadinya persaingan ruang antara spesies atau antara populasi karang yang tercermin dalam ukuran koloni yang relatif besar. Fenomena “tidak adanya persaingan ruang” juga ditemukan oleh Moll (1983) dalam komunitas karang di Kepulauan Spermonde. Sebagai contoh, karang P. verrucosa di Atol Enewetak memperlihatkan pola reproduksi yang tergolong pengeram yang hermafrodit (brooding hermaphrodite) (Stimson, 1978) dengan ciri ukuran koloni yang relatif lebih kecil. Berbeda halnya di terumbu karang PBL, ukuran koloni dari spesies ini bisa mencapai 90 cm yang secara tidak langsung menunjukkan kondisi ekologi lingkungan yang baik sehingga koloni karang dapat tumbuh dalam ukuran yang relatif besar.
REFERENSI
Babcock, R.C., Bull, G.D., Harrison, P.L., Heyward, A.J., Oliver, J.K., Wallace, C.C., Willis, B.L., 1986. Synchronous spawnings of 105 sclrecatinian coral species on the Great Barrier Reef. Mar Biol 90: 379-394.
Glynn, P.W., Gassman, N.J., Eakin, C.M., Cortés, J., Smith, D.B., Guzmán, H.M., 1991. Reef coral reproduction in the eastern Pacific:Costa Rica, Panama, and Galapagos Islands (Ecuador). I. Pocilloporidae. Mar Biol 109: 355-368.
Glynn, P.W., Colley, S.B., Eakin, C.M., Smith, D.B., Cortés, J., Gassman, N.J., Guzmán, H.M., Del Rosario, J.B., Feingold, J.S., 1994. Reef coral reproduction in the eastern Pacific: Costa Rica, Panama, and Galápagos Islands (Ecuador). II. Poritidae. Mar Biol 118: 191-208.
Harriott, V.J., 1983. Reproductive seasonality, settlement and post settlement of Pocillopora damicornis (Linnaeus) at Lizard Island, Great Barrier Reef. Coral Reefs 2: 151-157.
Harrison, P.L., Wallace, C.C., 1990. Reproduction, Dispersal and Recruitment of Scleractinian Corals. Di dalam: Dubinsky (ed.). Coral Reefs : Ecosystems of The World 25. Amsterdam– Oxford - New York – Tokyo: Elsevier. hlm 132-207.
Humason, G.L., 1962. Animal Tissue Techniques. San Francisco and London: WH. Freeman and Company.
Kojis, B.L., 1986a. Sexual reproduction in Acropora (Isopora) species (Coelenterata: Scleractinia) I. A. cuneata and A. palifera on Heron Island reef, Great Barrier Reef. Mar Biol 91: 291-309.
Kojis, B.L., 1986b. Sexual reproduction in Acropora (Isopora) (Coelenterata: Scleractinia) II. Latitudinal variation in A. palifera from the Great Barrier Reef and Papua New Guinea. Mar Biol 91: 311-318.
Moll, H., 1983. Zonation and diversity of reefs off SW. Sulawesi, Indonesia. Ph.D Thesis. University of Leiden. 102 hlm.
Nakir, M.N., 2003. Reproduksi seksual karang keras Pocillopora damicornis di perairan Pulau Barranglompo, Makassar. Ringkasan Hasil Penelitian. Makassar: Jurusan Ilmu Kelautan, Fakultas Ilmu Kelautan dan Perikanan, Universitas Hasanuddin. 24 hlm.
Richmond, R.H., Jokiel, P.L., 1984. Lunar periodicity in larva release in the reef coral Pocillopora damicornis at Enewetak and Hawaii. Bull Mar Sci 34(2): 280-287.
Richmond, R.H., Hunter, C.L., 1990. Reproduction and recruitment of corals: comparisons among the Caribbean, the Tropical Pacific, and the Red Sea. Mar Ecol Prog Ser 60: 185-203.
Richmond, R.H., 1997. Reproduction and Recruitment in Corals: Critical Links in the Persistence of Reefs. Di Dalam: Birkeland C. (ed.). Life and Death of Coral Reefs. New York: Chapmann & Hall. hlm 175-197.
Sakai, K., Shinjo, K., Hayashi, C., 2000. Sex allocation in scleractinian corals. Int Coral Reef Symp, Japan. Tokyo: Science and Technology Agency-The Nippon Foundation-JAMSTEK. hlm 5 (Abstract).
Shlesinger, Y., Loya, Y., 1985. Coral community reproductive patterns: Red Sea versus the Great Barrier Reef. Science 228: 1333-1335.
Stimson, J.S., 1978. Mode and timing of reproduction in some common hermatypic corals of Hawaii and Enewetak. Mar Biol 48: 173-184.
Stoddart, J.A., Black, R., 1985. Cycles of gametogenesis and planulation in the coral Pocillopora damicornis. Mar Ecol Progr Ser 23: 153-164.
Szmant-Froelich, A.M., 1985. The effect of coloni size on the reproductive ability of the Caribbean coral Montastrea annularis (Ellis and Solander). Proc 5th Int Coral Reef Cong, Tahiti 4: 295-300
Szmant AM. 1986. Reproductive ecology of caribbean reef corals. Coral Reefs 5: 43-54.
Wallace CC. 1985. Reproduction, recruitment and fragmentation in nine sympatric species of the coral genus Acropora. Mar Biol 88: 217-233.
Ward S. 1992. Evidence for broadcast spawning as well as brooding in the scleractinian coral Pocillopora damicornis. Mar Biol 112: 641-646.
Zakai D, Levy O, Chadwick-Furman NE. 2000. Experimental fragmentation reduces sexual reproductive output by the reef-building coral Pocillopora damicornis. Coral Reefs 19: 185-188.

 a terjadi di musim kemarau, yaitu bersamaan dengan peningkatan suhu perairan. Namun peningkatan suhu secara terus-menerus akan membuat pertumbuhan karang naik sampai pada titik tertentu dan kemudian menurun karena penurunan laju metabolisme dan fotosintesis zooxanthella (Tomascik et al., 1997). Menurut Buddemeier dan Kinzie (1976), karang hidup optimal pada batas toleransi tertentu terhadap suhu yaitu pada kisaran 25-29oC, meskipun demikian beberapa jenis karang dapat hidup pada suhu minimum 14oC dan beberapa jenis lainnya ditemukan pada suhu maksimum 36-40oC, namun laju pertumbuhannya sangat menurun.
a terjadi di musim kemarau, yaitu bersamaan dengan peningkatan suhu perairan. Namun peningkatan suhu secara terus-menerus akan membuat pertumbuhan karang naik sampai pada titik tertentu dan kemudian menurun karena penurunan laju metabolisme dan fotosintesis zooxanthella (Tomascik et al., 1997). Menurut Buddemeier dan Kinzie (1976), karang hidup optimal pada batas toleransi tertentu terhadap suhu yaitu pada kisaran 25-29oC, meskipun demikian beberapa jenis karang dapat hidup pada suhu minimum 14oC dan beberapa jenis lainnya ditemukan pada suhu maksimum 36-40oC, namun laju pertumbuhannya sangat menurun.